BIOQUÍMICA
Y aquí os dejamos el segundo tema de la asignatura. En el, trataremos el tema de las enzimas; esas pequeñas moléculas de estructura proteica que tienen la capacidad de catalizar las reacciones químicas según sea su función, ya sea ralentizando, acelerando o inhibiendo la reacción.
Existen muchos tipos de enzimas así que para diferenciarlos, los clasificaremos según el tipo y la función que desempeñan.
Tema 2-Diferencias entre enzimas reguladores y comunes
Def: Los enzimas van a regular la
velocidad de A -------- B, con un ritmo para la obtención
de producto final.
La
célula posee enzimas más específicos que los comunes y son los encimas reguladores.
v Encimas reguladores:
Def: Los encimas reguladores son más
complejos y de mayor tamaño y están constituidos por más de una cadena
polipeptídica.
Pueden
ser de dos tipos: Alostéricos y
Modulados Covalentemente.
o Alostéricos:
-
Regulados por unión NO covalente de
moduladores.
-
Elevado peso molecular
-
De naturaleza proteica de más de una
cadena polipeptídica
-
Forma globular
-
Poseen:
a)
Centro activo
b)
Centro regulador (10 más)
Los centro reguladores tienen la capacidad
de reunir moduladores, que son moléculas que van a controlar la actividad del
enzima.
Los moduladores pueden ser de dos tipos:
1)
Positivo: cuando se asocia al enzima
estimula la actividad catalítica.
2)
Negativo: disminuye u actividad
catalítica
Por lo tanto la velocidad depende de las
necesidades de la célula.
El centro regulador es específico para sus
moduladores, así como el centro activo es específico para sus substratos.
Los centros
receptores no tienen porque ser iguales y los moduladores tampoco son iguales.
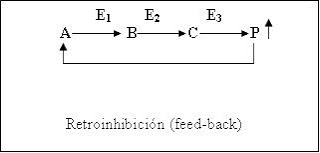
En muchos casos el producto final actúa
como modulador negativo del enzima alostérico y se paraliza de este modo la vía
metabólica o disminuye la producción.
Cuando sea necesaria la producción de
productos se liberarán los centros alostéricos o reguladores y aumenta la
actividad.
En algunos casos los moduladores positivos
son las moléculas de substrato porque hay gran cantidad.
Pueden tener efecto:
a)
Homotrópico: el substrato es el
modulador
b)
Heterotrópico: el modulador es
distinto al substrato.
Ø
Funcionamiento
En algunas vías
metabólicas la E que cataliza la 1ª etapa de la serie, suele ser inhibida por
el producto de la última, cuando la concentración de este producto final es
elevada, ello indica que su elaboración excede las necesidades y se frena el
funcionamiento de la vía reduciendo la actividad de la E reguladora.
También puede ser que una
enzima sea estimulada por algún agente que se acumule en el medio cuando existe
un exceso de substrato, el mismo promueve su utilización activando a la E se
une a ella en un lugar distinto del centro activo o sea en el centro regulador.
o
Enzimas modulados covalentemente:
Tienen una vida más
larga
Son enzimas que la célula conserva por más
tiempo. Cuando los necesita los activa, el enzima se activa cuando se incorpora
a su estructura un grupo químico y se une al enzima por enlace covalente
(fuerte) y se inactiva cuando se rompe el enlace covalente y se separa ese
grupo químico. El añadir grupos químicos siempre implica la acción de otra
enzima.
- No tiene propiedades autocatalíticas, necesitan de otras enzimas para activarse
- Se pueden presentar en la célula bajo dos formas:
a)
Activa
b)
Inactiva
Ej. Glucogenofosforilasa (enzima que degrada el glucógeno).
Si hay baja
concentración de glucosa en sangre, el hígado tiene que liberar glucosa a la
sangre de la que tiene almacenada en forma de glucógeno y lo hace de la
siguiente forma.
Si los niveles de
glucosa en sangre están bién, la glucofosforilasa se inactiva (fosfatasa).
La forma activa, es una
doble hélice de cadenas polipeptídicas, en los extremos tiene serina (aa) que
tiene que ser fosforilada, es decir poseer P. La forma inactiva no posee P.
Quinasa + P = activa
Fosfatasa – P = inactiva
v Enzimas NO reguladores:
Los enzimas No reguladores pueden
ser de dos tipos: Proencimas o zimógenos
e isoenzimas.
o
Proenzimas:
El proenzima, es una enzima que se
fabrica de forma inactiva, por lo tanto son precursores inactivos de las
enzimas. Una vez activos no pueden inactivarse (diferentes a los modulados
covalentemente).
Se
sintetizan inactivos sino degradarían el tejido, posteriormente por medio de E
o iones pasan a su forma activa
Se sintetizan inactivos en el
páncreas, van al tubo digestivo, pierden aa y son activados por enzimas de las
propias células de la mucosa intestinal.
El
enzima que se acaba de activar tiene propiedades autocatalíticas, es decir,
puede activar a otras proenzimas
En el intestino las proteínas
son degradadas por la tripsina y quimiotripsina, pero estos se crean de forma
inactiva en el páncreas, tripsinógeno y quimiotripsinógeno.
En el intestino delgado deben de ser activados.
Cuando algunos zimógenos son activados antes de tiempo en
el interior de las células provocan la autodigestión del tejido pancreático
(pancreattis).
o
Isoenzimas:
Son formas moleculares distintas de
un mismo enzima en distintas células pero actúan sobre el mismo substrato,
aunque no tienen la misma afinidad por él aunque si lo reconocen.
Son proteínas con distinta
estructura pero catalizan la misma reacción; difieren en los mecanismos de
regulación y en las características cinéticas (velocidad, Km…)
Desde el punto de vista fisiológico,
la existencia de isoenzimas permite que haya enzimas similares con diferentes
características personalizadas a los requerimientos de cada tejido.
Ej. Lactato
deshidrogenasa del suero humano, hay 5 formas:
LD1---HHHH---Corazón,
músculos (2ªabundante en suero)
LD2---HHHM---Leucocitos
(más abundante en suero)
LD3---HHMM---Pulmones
(3ª abundante en suero)
LD4---HMMM---Riñones,
páncreas (4ª abundante en suero)
LD5---MMMM---Hígado, músculo
esquelético (5ª abundante en suero
La LDH pasa a la sangre ante
toda destrucción de estos tejidos por lo que si aumenta su presencia en suero
indica que un órgano o tejido ha sido lesionado.
Es valiosa para diagnósticos de enfermedades.






No hay comentarios:
Publicar un comentario